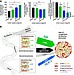
カーボカウントをご存じですか? ~インスリン注射に振り回されないために~
~免疫チェックポイント阻害薬による副作用としての1型糖尿病~
はじめに
京都大学の本庶佑先生が、免疫をつかさどる細胞にある「PD-1」という新たな物質を発見し、その後、その物質が免疫の作用を抑えるブレーキとしての役割を担っていることを明らかにしました。その業績が評価され、2018年にノーベル医学生理学賞を受賞されています。実際にその仕組みを利用した抗がん剤が、既存の抗がん剤では有効な治療成績をあげることができなかったタイプの癌に対しても良好な治療成績を発揮しています。しかし、その免疫作用に影響を及ぼすという薬の特性の影響で、これらの抗がん剤には免疫に関連した副作用が少なからず報告されています。今回は、その中でも1型糖尿病の発症について考えてみたいと思います。
免疫チェックポイント阻害薬とは
免疫チェックポイント阻害薬と呼ばれる抗 programmed cell death-1 (PD-1)抗体は、免疫に関与しているT細胞の活性化や増殖能を維持させることで、腫瘍(癌)に対して効果を発揮する薬剤です。既存の抗腫瘍薬よりも優れた効果を発揮することから、抗 PD-1 抗体は急速に適応範囲が広がっています。
日本においては、悪性黒色腫、非小細胞肺癌、腎細胞癌、ホジキンリンパ腫、頭頚部癌、胃癌、MSI-High大腸癌、食道癌、胸膜中皮腫の治療に承認されており、欧米では上記に加えて、尿路上皮癌、結腸直腸癌、肝細胞癌などの治療にも利用されています(糖尿病 62(1):37~46, 2019)。
免疫関連有害事象とは
しかし、この免疫チェックポイント阻害薬の使用増加に伴い、免疫関連有害事象(irAE)と呼ばれる有害事象(副作用)の発症が多く報告されています(Eur J Cancer 54: 139-148, 2016)。
実際に間質性肺炎、大腸炎、甲状腺機能低下症、肝炎、皮膚発疹、重症筋無力症、神経障害、筋炎、ブドウ膜炎(眼)、1型糖尿病などの発症が報告されています(Eur J Cancer 54: 139-148,2016, 下図参照)。
岡山赤十字病院医学雑誌, 32(1):58-65, 2021
免疫チェックポイント阻害薬関連糖尿病
これらの抗PD-1抗体などの免疫チェックポイント阻害薬に関する種々の免疫関連有害事象の中でも劇症 1 型糖尿病(数日でインスリン分泌が枯渇してしまうタイプの1型糖尿病)や1型糖尿病は発症が急激で、7割以上が糖尿病性ケトアシドーシスで発症しています。
免疫チェック阻害薬を使用開始してから発症までの期間にはばらつきがあることや、海外では約半数が陽性となる膵島関連自己抗体が、日本ではほとんど陰性となっていることなどから、糖尿病の発症を予想することは難しいとされています。
また、インスリンを作り出す細胞の炎症が原因のためインスリン分泌能が回復しない例が多いようです(Diabetol. Int. 10 :58-66, 2018, Eur. J. Endcrinol. 181(3): 363-374, 2019, Diabet. Med. 36 :1075-1081, 2019)。
日本糖尿病学会が実施した調査研究委員会の報告では、
〇薬剤投与から発症までの平均期間が155日(13~504日)とかなり幅があること
〇50%が急性1型糖尿病、50% が劇症1型糖尿病で発症が急激であること
〇劇症1型糖尿病であっても一般的な劇症1型糖尿病よりもインスリンの完全枯渇がやや遅くなる(2~3週間)ことが多いこと
〇薬剤中止後数か月たって発症したケースもあること
が報告されています(糖尿病 62(1):37~46, 2019)。
さいごに
抗PD-1抗体などの免疫チェックポイント阻害薬による1型糖尿病については、使用される本人や家族、さらには医療従事者やスタッフへの啓蒙が大切です。免疫チェックポイント阻害薬を使用している場合は、定期的な血糖値の確認が必要です。また、糖尿病内科医の立場としては、1型糖尿病を発症した場合は、適切にインスリン治療を行うことで、出来るだけ癌の治療の妨げにならないようにすることも重要だと考えています。もしチェックポイント阻害薬以外に代替できる有効な治療法がなければ、全身状態や血糖値をしっかりと管理しながら、癌に対する治療を優先するという考え方もあり得ると考えています。いずれにしても、癌への治療を続けられるよう、血糖管理の面で支援していくことも糖尿病診療に携わる私たちの役割です。